La Capa de Ozono
El ozono y su importancia para la supervivencia de las especies

El OZONO
El ozono es una variedad alotrópica del oxígeno, esto es que el oxígeno puede existir como elemento de más de una forma, una de estas es la que conocemos como ozono.El oxígeno raramente existe en estado monoatómico (O); normalmente se asocia con otro átomo del mismo elemento y adopta la forma biatómica (O2) que es con la que estamos más familiarizados, siendo esta molécula más estable.
Cuando al oxígeno biatómico O2 le suministramos energía se forma la molécula de ozono, O3 mediante la reacción: 3O2 (g) + Energía -> 2O3 (g)
El gas ozono tiene un color agudo y permanente. En su estado puro es de color azul. Cuando se enfría a 162º K (punto de ebullición), el ozono forma un líquido azul oscuro que es explosivo en virtud de la tendencia espontánea del ozono para descomponerse en oxígeno.
Si se lo enfría para llegar a los 251,4 ºC bajo cero (punto de fusión), es un sólido de color violeta negruzco. Se descompone en presencia de Cloro y oxida a la mayor parte de los metales. Es más estable a altas temperaturas, y es muy peligroso ya que en ciertas concentraciones es violentamente explosivo.
Se ha utilizado para purificar agua, destruye la materia orgánica, o el aire en hospitales, submarinos, etc. Puesto que la oxidación de compuestos coloreados suele dar lugar a compuestos incoloros, el ozono se utiliza como agente blanqueador para ceras, almidón, grasas y barnices.
Cuando se agrega en pequeñas cantidades al aire, el ozono elimina los olores, pero se debe utilizar con cuidado y en concentraciones muy bajas puesto que irrita los pulmones.
LA GENERACIÓN DE OZONO
El ozono se produce cuando grandes cantidades de energía se ponen en contacto con las moléculas de oxígeno, haciendo que estas se dividan en átomos individuales (radicales libres), estos a su vez reaccionan con moléculas de oxígeno, reacción favorecida por la presencia de un catalizador en el medio, y forman moléculas de ozono.
Este gas es sumamente inestable y el tercer átomo de oxígeno tiende a escaparse generalmente unos segundos después de su formación.
Las mayores cantidades de ozono de la atmósfera se producen por acción de los rayos ultravioletas, que penetran en esta y la altura de la estratósfera, entre los 10 a los 50 Km., producen una reacción fotoquímica.
El oxígeno es prácticamente transparente a la luz visible (400 a 800 nm), y al UV próximo (240 a 360 nm), pero es un gran absorbente de la radiación del extremo UV del espectro (160 a 240 nm).
Cada fotón de esta longitud de onda impacta disocia una molécula de oxígeno en 2 radicales libres:
O2 + hv ->O + O
O + O2 + M -> O3 + M
Siendo M un catalizador.
Una vez obtenida la molécula de ozono, recomienza el proceso cuando un fotón impacta contra esta revirtiendo la reacción:
O3 + uv ->O2 + O
Las reacciones de producción fotoquímica de ozono y de destrucción del mismo se llama respectivamente: ozogénesis y ozonólisis. Estas dos reacciones conducen a un equilibrio fotoquímico mediante el cual se mantiene una pequeña concentración de O3 en la alta atmósfera que protege a manera de escudo a los seres vivos que habitan la Tierra de los rayos ultravioletas.
El ozono cuenta con la ayuda de gases reservorios que lo protegen reaccionando con algunos catalizadores.
Estos gases son HC1, HOCL y CIONO2 (este último puesto en duda como veremos más adelante). La formación del ozono se da en la alta estratósfera, sobre todo en el Ecuador donde la radiación solar y por lo tanto también la de UV, llegan en forma vertical. Desde aquí es transportado hacia los polos y la baja estratósfera.

El ozono comparte la estratósfera con el oxígeno, el vapor de agua, el dióxido de carbono, el hidrógeno y el nitrógeno. Generar ozono en forma industrial es un proceso común que consiste en someter al aire o a oxígeno a una descarga eléctrica, si bien es un procedimiento sencillo, es caro.
Otro método de generación de ozono se dá como consecuencia de la urbanización del hombre; el aire que está sobre los continentes se enturbia y filtra casi todas las ondas más cortas que ya han atravesado la capa de ozono.
Los óxidos de nitrógeno y los hidrocarburos tienen características negativas que con un poco de luz (UV) se descomponen formando ozono en la baja atmósfera lo que trae como consecuencia nauseas y efectos irritantes en las vías aéreas superiores de las personas y de animales.
LA RADIACIÓN ULTRAVIOLETA
El sol emite radiación de diferente longitud de onda, la parte del espectro radiante que se encuentra comprendida entre los 100 nm y los 390 nm aproximadamente es a la que llamamos radiación ultravioleta.
Existen tres tipos de esta radiación:
a) UV-A de mayor longitud de onda
b) UV-B de longitud de onda intermedia
c) UV-C de menor longitud de onda
La radiación UV-C es la más penetrante y letal para la vida de la biosfera.
Casi el 99% de la radiación ultravioleta del Sol que alcanza la estratósfera se convierte en calor mediante una reacción química que continuamente recicla moléculas de ozono.
DISTRIBUCIÓN DEL OZONO EN LA ATMÓSFERA
La distribución del ozono en la atmósfera es variable, depende de la altitud, de la época del año, de la temperatura, y acompaña también al ciclo solar.Una variable importante en esta distribución es el momento de apertura del vórtice polar.
Este es un enorme remolino que se forma en la atmósfera sobre el polo sur, que produce corrientes de aire circulares y huracanadas que encierran masas de gases. Esto impide el intercambio de estos gases con el exterior, por causa de la formación de una pared de corrientes de aire.
Este proceso evita el ingreso de las corrientes cálidas del Ecuador cargadas de ozono. Este fenómeno que controla en gran medida la cantidad de O3 en la atmósfera polar solo se presenta en el Polo Sur debido a que el Polo norte tiene un relieve que impide la formación de remolinos. También la presencia de cadenas montañosas de Norte América, Europa y Asia frenan la llegada de los vientos.

Cl2 ->Cl + Cl
estos radicales son muy activos y comienzan el ciclo destructor del ozono en la estratósfera.
Los años en que se registraron las menores concentraciones de O3, fueron en los que el vórtice se abrió más tardíamente.
Otro factor que influye es la diferencia de temperaturas entre los polos, siendo la temperatura del Polo Sur 10 a 15 ºC menor que la del Polo Norte. El punto de máxima concentración del ozono es en la estratósfera a las 22 km. de altura.
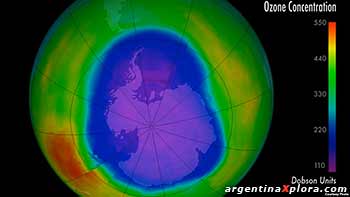
¿COMO SE MIDE EL OZONO?
Las mediciones de concentración de O3 en la atmósfera se realizan con globos sonda, con cohetes o con satétites provistos de expectógrafos que analizan la radiación.Las primeras mediciones son del año 1930 de una estación meteorológica de Arosa en Suiza.
Estas concentraciones se miden en unidades Dobson, donde:
1 UD = 2.7 x 1018 (moléculas O3/cm3)
Entre los trópicos la concentración normal es de 250 a 260 UD, en latitudes mayores las concentraciones superan las 400 UD; en el polo sur en septiembre, octubre durante la primavera son 125 a 150 UD.
EL DEBILITAMIENTO DE LA CAPA DE OZONO
Según los científicos que estudian la historia de la vida sobre la Tierra, esta habría sido muy diferente si la radiación ultravioleta hubiese alcanzado la superficie planetaria sin filtro alguno. Por ejemplo, la fotosíntesis de las plantas habría podido operar con fotones de mucha mayor energía y la influencia de esos rayos sobre los cromosomas podría haber producidomutaciones genéticas mucho más frecuentes. Dado que la presencia del ozono actúa como un escudo filtrante que nos protege de la incidencia de los rayos UV, el debilitamiento de este permitiría la entrada de mayor cantidad de dicha radiación.
En la vida vegetal el exceso de radiación produciría alteraciones en los ciclos de las cosechas, como así también mutaciones.
En humanos y animales, los efectos pueden ser diversos. Algunos ejemplos de ello son los melanomas (cáncer de piel); en Europa, de todos los tipos de cáncer, el de piel representa el 20 % del total; el aumento en los casos de cataratas oculares se calcula que: por cada uno por ciento de disminución de la capa de ozono, habrá cien mil casos más de ceguera en todo el mundo; depresión del sistema inmunológico, etc.
En la vida marina, se detectó que la incorporación de carbono por las poblaciones de fitoplancton natural es inhibida por los rayos UV-B. Por otra parte otros experimentos demostraron que las exposiciones prolongadas a radiación UV-B, producen cambios importantes en la pigmentación del fitoplancton por deficiencias en el proceso de fotosíntesis.

Por último están las bacterias y el krill, que al dañarse o morir (siendo estos la base de la cadena alimentaria) pueden desencadenar graves consecuencias entre los miembros de ecosistema con el agravante que el plancton es el mayor productor de oxígeno del planeta. Sin él, la vida del hombre en la Tierra sería casi imposible.
Cabe aclarar que estos organismos pueden llegar a desarrollar mecanismos de protección y adaptación frente a estas alteraciones.
La producción de comida podría ir cesando en forma progresiva (los vegetales son muy sensibles al incremento de los rayos UV); esto inhibiría su crecimiento y los cultivos decrecerían.
TEORÍAS SOBRE LA PERDIDA DEL OZONO EN LA ESTRATOSFERA
La teoría más difundida y de aceptación más generalizada, es la que señala a los CFCs (Clorofluorocarbonos), como los causantes del adelgazamiento de la capa de ozono; pero no es la única. Debido a que las mediciones de ozono son desde el punto de vista planetario relativamente recientes, no sabemos si estamos frente a un proceso cíclico natural o a un proceso destructor generado por la actividad industrial.Esto no cambia el resultado que es la evidencia de la aparición de agujeros reales en partes de esta capa, que se extienden sobre las regiones Antártica y Ártica, durante sus respectivos veranos.
CUANDO SE ROMPE EL CICLO
Las fluctuaciones del ozono se deberían a un proceso natural y cíclico de formación y destrucción. Esta capa de ozono se acomodaría a las radiaciones UV. Según Robert Pease, profesor de climatología de la Universidad de California, el ozono es un recurso infinito. En otras palabras, nunca se acabará mientras haya aire y luz solar. Este asegura que los CFCs no pueden llegar lo suficientemente alto, debido a que la inversión termal que se produce en la estratósfera no permite el intercambio de gases, incluidos los CFCs. En el caso que alguna molécula de estos llegase a la capa de ozono, es (cientos de millones de veces) más probable que la radiación UV impacte en una molécula de oxígeno, para formar ozono que en una de CFC para iniciar el ciclo de destrucción. Por lo tanto, se formarían más moléculas de ozono que las que desaparecerían.
Por otra parte, ya en 1956, el científico británico Gordon Dobson informó acerca de un descenso de los niveles de ozono en la Antártida; en esta época los CFCs prácticamente no se usaban.
En 1968, después de 40 años de investigaciones sobre el ozono, escribía: "Uno de los resultados más interesantes...fue la peculiar variación anual en el ozono en la zona de Bahía Halley (Antártida).
De acuerdo a los estudios de Dobson y otros análisis, se puede deducir que la disminución cíclica del ozono sobre el polo sur se debe a una combinación de factores que incluyen las erupciones volcánicas, los ciclos de manchas solares (que provocan la variación de la radiación UV) y el riguroso clima de la Antártida. Según la profesora Galloni, los gases emitidos desde la superficie terrestre y que alcanzan bajas concentraciones, influyen sobre los procesos químicos de la estratósfera y también en los los procesos fotoquímicos de la estratósfera, modificando las condiciones físicas locales de la atmósfera (temperatura, insolación).
LOS CLOROFLUORO CARBONOS
La principal causa de la pérdida de ozono, según esta teoría, son un grupo de productos químicos sintéticos conocidos como Clorofluorocarbonos.Fueron sintetizados por primera vez en la década del 20, a partir de átomos de flúor, carbono y cloro, son inertes, no tóxicos, económicos y simples de fabricar, con la capacidad de gasificarse a bajas temperaturas.
Estos productos son utilizados en todo el mundo en los sistemas de refrigeración que incluyen a las heladeras, congeladores, aire acondicionados, etc. Se usan también en los extinguidores de incendios, particularmente en los pequeños extinguidores de uso doméstico, como propelentes de aerosoles, como base de limpiadores de microchips de computadoras, en la industria del telgopor, etc...

Durante muchos años, los químicos creyeron que los CFCs liberados al aire se difundía inofensivamente hacia la atmósfera superior, donde eran degradados por la luz solar. Debieron pasar más de 40 años para los científicos advirtieran el debilitamiento de la capa de ozono como consecuencia del uso de estos compuestos.
Debido a esto la compañía norteamericana Du Pont, que fue quien los inventó, comenzó a desarrollar sustitutos.
La alarma suena en 1974 cuando Sherwood Rowland y Mario Molina de la Universidad de California previenen sobre el impacto destructivo de los CFCs en presencia de radiación ultravioleta; los clorofluorocarbonos reaccionan contra el ozono: inicialmente, la radiación ultravioleta desprende un átomo de cloro de la molécula de CFC. El átomo de cloro reacciona luego con una molécula de ozono, separándola en una reacción que aparentamente no es seguido por la resíntesis de dicha molécula. Un solo átomo de cloro puede reaccionar con -y destruir- cien mil moléculas de ozono.
Un último informe publicado por científicos de la Universidad de Cambridge, determina que el CIONO2 (hasta ahora considerado reservorio) destruye el ozono de la estratósfera hacia fines de la primavera en regiones cálidas. Por un proceso químico que no requiere de las bajas temperaturas del invierno polar. El CIONO2 se activa cuando se evaporan las nubes estratosféricas de HNO3 y es transportado por vientos hacia regiones más cálidas.
Los análisis de esta reacción sugieren fuertemente que si la adición de CFCs a la atmósfera continua sin ser controlada, la capa de ozono finalmente será destruida por completo.
Sobre la base de los datos actuales, se estima que para el año 2000 habrá una reducción del 5% en la capa de ozono. Esta estimación esta basada en la cantidad de CFCs que ya han sido liberados a la atmósfera. Mientras tanto, la producción mundial de CFCs ha seguido incrementando incrementándose a una tasa de 4,5% por año -llevando a predecir que la capa de ozono se reducirá un 60% hacia el año 2050- Los modelos matemáticos predicen que una reacción del 16% den la capa de ozono aumentaría la cantidad de radiación ultravioleta que llega a la superficie de la Tierra en un 40%: y un 30% de reducción duplicaría esta cantidad.
Existen cuatro clases principales de compuestos provenientes de las actividades humanas que pueden afectar el ozono atmosférico:
▶ Gases manufacturados industrialmente (haluros de alquilo)
▶ Gases emitidos en la producción y consumo de combustibles de carbón de origen fósil (CO2, CO,N2, NOx).
▶ Gases originados por la combustión de biomasa (cloroformo, sulfuro de carbonilo, óxidos de nitrógeno, CO2, CO).
▶ Gases de origen biológico emitidos desde tierras agrícolas: el suelo y a vegetación, afectados por la exploración o por la descomposición de residuos originados por los seres humanos y los animales.
